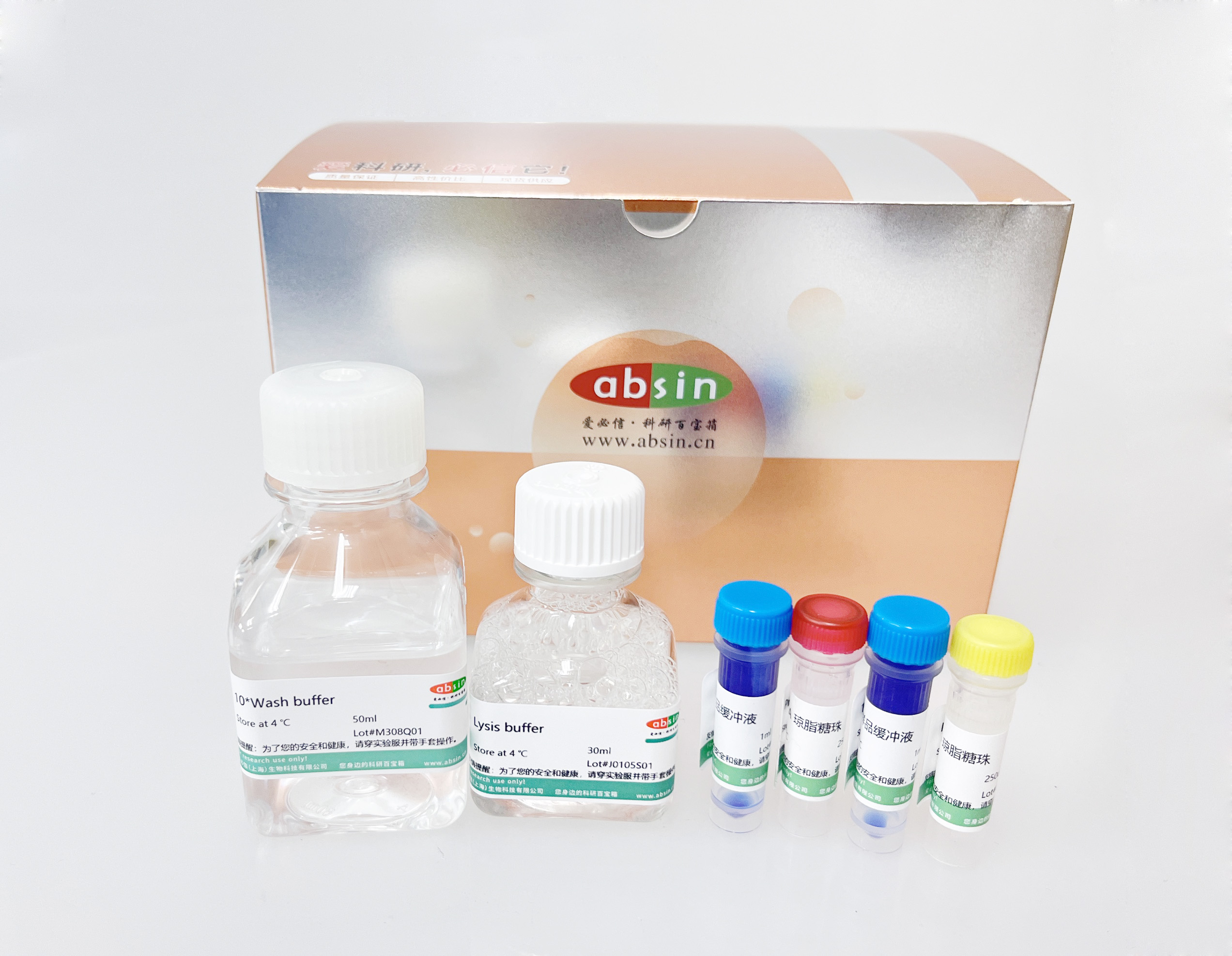
免疫(共)沉淀(IP/CoIP)试剂盒
| 货号-规格 | 货期 | 价格 | 数量 |
| abs955-50T | 1-2周 | ¥2625.00 | - + |
 大包装询价
大包装询价| 试剂名称 | 体积 | 保存条件 |
| Lysis buffer | 30ml | 4 ℃ |
| 10*Wash buffer | 50ml | 4 ℃ |
| 1*SDS 样品缓冲液 | 1ml*2 | 4 ℃ |
| Protein A 琼脂糖珠 | 250ul | 4 ℃ |
| Protein G 琼脂糖珠 | 250ul | 4 ℃ |
A. 制备细胞裂解物
1. 吸干培养基。添加含有调节分子的新鲜培养基,使其在预定的时间内对细胞进行处理。
2. 收集细胞,去除培养基后用冰预冷的 1 X PBS 洗涤细胞一次。
3. 去除 PBS 并在每个细胞板上(10 cm)加入 0.5 ml 冰预冷的 Lysis buffer,并在冰上孵育至少5分钟。
4. 从板上刮下细胞,把提取物转移至微量离心管。置于冰上。
5. 在冰上进行 3 次超声破碎,每次 5 秒。(PS:超声条件需根据液体量、探头直径以及最大功率调整。以200W功率超声仪器为例,用 3 mm 的探头。我们一般推荐使用 35%-40% 的最大功率进行 3 次超声脉冲, 每次超声之间停顿 10 秒。)
6. 在 4 °C,在 14,000 x g 条件下,微量离心10分钟,将上清转移到新管中。上清液即为细胞裂解物。如有必要,裂解物可保存在 -80 °C。
注:细胞裂解物制备好之后,可先进行蛋白免疫印迹法检测,以此来确定细胞裂解物里存在目标蛋白。
B. 免疫沉淀法
a) 细胞裂解物预清除(可选步骤)
1. 向 500 μl(含总蛋白 200 -1000 ug)细胞裂解物中添加 5 μl Protein A 和 5 μl Protein G。
2. 在 4 °C 下,旋转孵育 30 - 60 分钟。
3. 4°C 条件下 12000g 离心1分钟,保留上清,待用。
b) 抗原抗体结合
1. 在新的离心管内加入 500 μl (含总蛋白 200 – 1000 ug)细胞裂解物(可以是预清洗后的细胞裂解物)。
2. 加入目标蛋白的单克隆/多克隆抗体(1 – 5 μg)。
3. 同时采用非特异免疫的同源抗体作为对照。
4. 在 4 °C 轻柔混合过夜。
c) 免疫复合物沉淀
1. 抗体孵育过夜后,加入 5 μl Protein A 和 5 μl Protein G。
2. 在 4 °C 温和地混匀1- 3小时或过夜。
3. 12,000 g 离心1 分钟,保留沉淀。
4. 使用 0.5 ml 1*Wash buffer 清洗沉淀,12,000 g 离心1分钟,保留沉淀。
5. 重复第4步,共计清洗3次。
注:清洗,去上清的时候需要注意避免吸走填料
C. 用蛋白免疫印迹法进行分析
1. 在 20 - 40 μl 1*SDS 样品缓冲液中重悬沉淀物,涡旋振荡,然后再微量离心30秒,以使附着管壁的珠子和液体到管底。
2. 将样品加热至 95 - 100 °C 并持续2 - 5分钟,然后在 14,000 g下瞬时离心1分钟,取上清液。
3. 将样品(15 – 30 μl)上样到 SDS-PAGE 凝胶上。
4. 用蛋白质印迹法分析样品。
注意:Protein A和Protein G的基质为20%乙醇,较易挥发,使用时应注意密封,如出现挥发情况,可使用20%乙醇重悬。
- 实验方法 实验条件
共 0 张,还能上传 8 张 提交
- 提示: 尊敬的客户您好,如果您对我们的产品有什么疑问或想要了解的,可以点击“我要咨询”按钮填写您的疑问。
提交不成功?请联系info@absin.cn。
- 磁珠法两种洗脱方案的区别?
- 两种洗脱方案均包含捕获抗体及目的抗原,低pH 洗脱样本中抗体为完整结构,变性洗脱样本中抗体解离为重链、轻链,请根据后续实验需求选择洗脱方案。
- 如果我后续是想要跑native胶,不做变性电泳,如何选择样品缓冲液?
- 用不含有SDS的WB上样缓冲液,但不经过变性,蛋白能否解离下来,我们无法确定,不能保证您后续的实验效果。
- beads出现吸不出来的情况,怎么处理?
- 吸之前需注意枪头要剪一下再吸,如若beads吸不上来,可加入等体积的20%乙醇混匀后再吸。
- 如何减轻琼脂糖珠非特异性吸附?
- 可以通过多次洗涤,和样品预处理(适当延长Protein A和Protein G的孵育时间)来降低背景,但应注意,选择此步骤后,试剂盒中protein A和protein G对应实验样本数减半。
- 试剂盒中lysis buffer都要添加PMSF吗,怎么使用?
- 该试剂盒中的PMSF都要额外准备,推荐abs9146,根据使用量,取每1mL lysis buffer加入10ul PMSF(100mM,溶解174mg的abs9146于足量的异丙醇中,定容到10mL,分装成小份贮存于-20℃。)使PMSF的最终浓度为1mM,混匀备用 (PMSF现用现加)。磁珠法缓冲液请按说明书配置后使用,buffer稀释均可用超纯水。
- 如何减轻琼脂糖珠非特异性吸附?
- 1、因为产品特性,抗体被困在孔内,难以洗去,因此需要多次洗涤来降低背景。
2、琼脂糖珠的多孔结构,可以吸附更多蛋白(也包括杂蛋白。)最好预处理一下再上样(适当延长Protein A 和 Protein G的孵育时间)。
- 如果我后续是想要跑native胶,不做变性电泳,不能用试剂盒里的1*SDS样本缓冲液,我应该用什么替代呢?
- 用不含有SDS的WB上样缓冲液,但不经过变性,蛋白能否解离下来,我们无法确定,不能保证您后续的实验效果
- 如果我的细胞裂解物里面蛋白含量高于试剂盒要求的总蛋白含量,我应该用什么试剂进行稀释呢?
- 常规用PBS稀释即可
- protein A和protein G beads怎么选?
- 各取5ul。
- 超声破碎冰上操作是必须的吗?4℃条件能否微调?
- 建议冰上操作,4℃可以微调。
- beads出现吸不出来的情况,怎么处理?
- 吸之前需注意枪头要剪一下再吸,如若beads吸不上来,可加入等体积的20%乙醇混匀后再吸。
- 如果没有超声破碎仪的话,能不能用酶解的办法破碎细胞?
- 酶解和超声都可以,酶按照实验室正常使用浓度配制即可。
- 实验的时候能抗体beads一起加吗?还是说先加抗体再加beads?
- 都可以,但我们建议参考产品说明书使用,先加抗体再加beads。
- 10*Wash buffer如何稀释?一定要使用配套的吗?
- dd水稀释即可,最终浓度是1 * washing buffer 即可。
- 怎么看出现的条带结果?
- 比较关注的是三条泳道,input和IgG以及检测互相作用的泳道,理论上input有一条目的条带, IgG没有条带。如果input没有条带,说明在进行免疫共沉淀之前没有进行WB验证,建议先验证之后 再重新操作。若IgG阴性对照出现条带,是不正常的,应是受重链和轻链的影响,说明使用的二抗 不正确, 建议更换特异性更强的二抗.
- 免疫共沉淀试剂盒裂解液能用于组织吗?比例又是如何?
- 可用于组织,要先将组织研磨成匀浆,比例和细胞比例一致。
- 阴性对照lgG组后续WB有条带一般是什么原因?
- 首先需要排除lgG和后续WB一抗同源导致的轻重链的干扰条带(25kd和50kd附近);再者建议参考本试剂盒免疫沉淀法“可选步骤”以排除Protein A/G的非特异性结合;再就是考虑lgG的问题可以换用其他品牌lgG尝试。
- 步骤上的可选步骤能否省略?
- 可选步骤为预处理,目的为去除样本中可与protein A/G非特异结合的蛋白质,减少干扰,如CoIP实验中发现有较多杂带,可考虑选做;但应注意,选择此步骤后,试剂盒中protein A和protein G对应实验样本数减半。
- Alpha-fetoprotein upregulates hepatocellular carcinoma cell-intrinsic PD-1 expression through the LATS2/YAP/TEAD1 pathway
Guangxian Leng, Hongxia Gong, Guiyuan Liu, Yin Kong, Liuqing Guo, Youcheng Zhang
BIOCHIMICA ET BIOPHYSICA ACTA-GENERAL SUBJECTS. 2024 May 01 ; 5
影响因子: 3
- Jianpi Antai formula prevents miscarriage by repressing M1 polarization of decidual macrophages through ubiquitination of NLRP3 mediated by MARCH7
Ying Zhao, Chenyun Miao, Ruye Wang, Yun Chen, Ning Ren, Jing Ma, Tao Gao, Qin Zhang
JOURNAL OF ETHNOPHARMACOLOGY. 2024 Apr 24 .
影响因子: 5.4
- The necroptosis-mediated imbalance of mitochondrial dynamics is involved in DEHP-induced toxicity to immature testes via the PGAM5-DRP1 interaction
Xiazhu Zhou, Yifan Hong, Jing Chen, Yihang Yu, Siyuan Wang, Yuexin Wei, Chunlan Long, Lianju Shen, Shengde Wu, Guanghui Wei
Environmental Pollution. 2024 Apr 01 .
影响因子: 8.9
- Super-enhancer-driven LIF promotes the mesenchymal transition in glioblastoma by activating ITGB2 signaling feedback in microglia
Han Xie, Yanyi Jiang, Yufei Xiang, Baoming Wu, Jiajia Zhao, Ruixiang Huang, Mengting Wang, Yunlong Wang, Jun Liu, Dejun Wu, Dasheng Tian, Erbao Bian
neuro-oncology. 2024 Mar 30 .
影响因子: 15.9
- The ADAM17 inhibitor ZLDI-8 sensitized hepatocellular carcinoma cells to sorafenib through Notch1-integrin β-talk
Chang Xu, Xudong Gao, Tianshu Ren, Hefeng Geng, Kaisi Yang, Yaoguang Huang, Weige Zhang, Shanbo Hou, Aigang Song, Yingshi Zhang, Qingchun Zhao
Pharmacological Research. 2024 Mar 24 .
影响因子: 9.3
- AQP4 Endocytosis-Lysosome Degradation Mediated by MMP-9/β-DG Involved in Diabetes Cognitive Impairment
Ye Yuan, Wei Peng, Jingna Lei, Yi Zhao, Beiyu Zhao, Yan Li, Jin Wang, Qiumin Qu
Molecular Neurobiology . 2024 Mar 21 .
影响因子: 5.1
- Targeted knockdown of PGAM5 in synovial macrophages efficiently alleviates osteoarthritis
Yuhang Liu, Ruihan Hao, Jia Lv, Jie Yuan, Xuelei Wang, Churong Xu, Ding Ma, Zhouyi Duan, Bingjun Zhang, Liming Dai, Yiyun Cheng, Wei Lu & Xiaoling Zhang
Bone Research. 2024 Mar 04 .
影响因子: 12.7
- Targeting the IRE1α-XBP1s axis confers selective vulnerability in hepatocellular carcinoma with activated Wnt signaling
Tingting Zhang, Faming Zhao, Yi Zhang, Ji-Hua Shi, Fengzhen Cui, Weixiang Ma, Kai Wang, Chuanrui Xu, Qingping Zeng, Rong Zhong, Ningning Li, Yong Liu, Yang Jin & Xia Sheng
Oncogene. 2024 Feb 28 .
影响因子: 8
- PRMT6 deficiency or inhibition alleviates neuropathic pain by decreasing glycolysis and inflammation in microglia
Tong Hua , Erliang Kong , Hailing Zhang , Jinfang Lu , Kesheng Huang , Ruifeng Ding , Haowei Wang , Jian Li , Chaofeng Han , Hongbin Yuan
BRAIN BEHAVIOR AND IMMUNITY. 2024 Feb 24 .
影响因子: 15.1
- USP14 exhibits high expression levels in hepatocellular carcinoma and plays a crucial role in promoting the growth of liver cancer cells through the HK2/AKT/P62 axis
Nannan Zhang, Hui Zhang, aobing Yang, Qiang Xue, Quhui Wang, Renan Chang, Lirong Zhu, Zhong Chen, ancheng Liu
BMC Cancer. 2024 Feb 21 ; 1
影响因子: 3.8
- Targeting EMSY-mediated methionine metabolism is a potential therapeutic strategy for triple-negative breast cancer
Cui-Cui Liu, Lie Chen, Yu-Wen Cai, Yu-Fei Chen, Yi-Ming Liu, Yu-Jie Zhou, Zhi-Ming Shao, Ke-Da Yu
Cell Reports Medicine. 2024 Feb 20 ; 2
影响因子: 14.3
- 1-Pyrroline-5-carboxylate inhibit T cell glycolysis in prostate cancer microenvironment by SHP1/PKM2/LDHB axis
Lei Chang, Guohao Li, Shan Jiang, Jie Li, Jin Yang, Kavita Shah, Le Zhou, Hanrui Song, Leyuan Deng, Zhiguo Luo, Yonglian Guo & Yutao Yan
Cell Communication and Signaling . 2024 Feb 08 ; 101
影响因子: 8.4
- NSD2 modulates Drp1-mediated mitochondrial fission in chronic renal allograft interstitial fibrosis by methylating STAT1
Jianjian Zhang, Weibin Xie, Bin Ni, Zhuohang Li, Dengyuan Feng, Yao Zhang, Qianguang Han, Hai Zhou, Min Gu, Ruoyun Tan
Pharmacol Research. 2024 Feb 01 .
影响因子: 9.3
- Phlorizin, a novel caloric restriction mimetic, stimulates hypoxia and protects cardiomyocytes through activating autophagy via modulating the Hif-1α/Bnip3 axis in sepsis-induced myocardial dysfunction
Yong-Wei Yu, Xia Chen, Jue-Yue Yan, Juan Hu, Kai-Yu Huang, Kang-Ting Ji, Hong-Liu Cai
International Immunopharmacology. 2024 Jan 05 .
影响因子: 5.6
- A Fanca knockout mouse model reveals novel Fancd2 function
Qian Wang, Jia Liu, Yixinhe Zhong, Dongbo Li, Yusen Zhong, Huazhong Ying, Tingting Zhang
BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS. 2023 Dec 31 .
影响因子: 3.1
- The Binding of HSPA8 and Mitochondrial ALDH2 Mediates Oxygen-Glucose Deprivation-Induced Fibroblast Senescence
Wenting Hui, Tongtong Song, Ling Yu, Xia Chen
Antioxidants. 2023 Dec 25 .
影响因子: 7
- Histone deacetylase-mediated silencing of PSTPIP2 expression contributes to aristolochic acid nephropathy-induced PANoptosis
Chuanting Xu, Qi Wang, Changlin Du, Lu Chen, Zhongnan Zhou, Zhenming Zhang, Na Cai, Jun Li, Cheng Huang, Taotao Ma
British Journal of Pharmacology. 2023 Dec 23 .
影响因子: 7.3
- Eldecalcitol prevents muscle loss and osteoporosis in disuse muscle atrophy via NF-κB signaling in mice
Zhang Haichao, Du Yanping, Tang Wenjing, Chen Minmin, Yu Weijia, Ke Zheng, Dong Shuangshuang, Cheng Qun
Skeletal Muscle. 2023 Dec 19 .
影响因子: 4.9
- Imatinib induces ferroptosis in gastrointestinal stromal tumors by promoting STUB1-mediated GPX4 ubiquitination
Sun Xiangfei, Zhang Qiang, Lin Xiaohan, Shu Ping, Gao Xiaodong, Shen Kuntang
Cell Death & Disease. 2023 Dec 18 .
影响因子: 9
- MET exon 14 skipping mutation drives cancer progression and recurrence via activation of SMAD2 signalling
Liang Qiaoyan, Hu Yajun, Yuan Qingyun, Yu Min, Wang Huijie, Zhao Bing
BRITISH JOURNAL OF CANCER. 2023 Dec 18 .
影响因子: 8.8
- CDC123 Promotes Hepatocellular Carcinoma Malignant Progression by Regulating CDKAL1
Yong Wang, HongTao Pan, XuanKun Gong, ZhiCheng Wang, XiLiang Qin, Shuai Zhou, Chao Zhu, XiaoSi Hu, ShiLei Chen, HuiChun Liu, Hao Jin, Qing Pang, WU Wen Yong
PATHOLOGY RESEARCH AND PRACTICE. 2023 Dec 16 .
影响因子: 2.8
- Histone deacetylase-mediated silencing of PSTPIP2 expression contributes to AAI-induced PANoptosis
Chuanting Xu, Qi Wang, Changlin Du, Jiahui Dong, Zhenming Zhang, Na Cai, Jun Li, Cheng Huang, Taotao Ma
BRITISH JOURNAL OF PHARMACOLOGY. 2023 Dec 10 .
影响因子: 7.3
- Melatonin alleviates pyroptosis by regulating the SIRT3/FOXO3α/ROS axis and interacting with apoptosis in Atherosclerosis progression
Cong Lin, Liu Xiankun, Bai Yiming, Qin Qin, Zhao Lili, Shi Ying, Bai Yunpeng, Guo Zhigang
BIOLOGICAL RESEARCH. 2023 Dec 02 .
影响因子: 6.7
- TRIM32 Inhibits NEK7 Ubiquitylation-Dependent Microglia Pyroptosis After Spinal Cord Injury
Yu Jiasheng, Feng Dongqian, Bao Lei, Zhang Bin
MOLECULAR BIOTECHNOLOGY. 2023 Nov 30 .
影响因子: 2.6
- Baicalin exerts neuroprotective actions by regulating the Nrf2-NLRP3 axis in toxin-induced models of Parkinson's disease
Jiahua Huang, Xinyue Zhang, Xueping Yang, Qingyun Yv, Fanlong Ye, Sheng Chen, Ying Cui, Linting Gu, Min Zhu, Wenwei Li
CHEMICO-BIOLOGICAL INTERACTIONS. 2023 Nov 26 .
影响因子: 5.1
- A novel scaffold long-acting selective estrogen receptor antagonist and degrader with superior preclinical profile against ER+ breast cancer
Bingsi Wang, Mingxu Ma, Yusen Dai, Pengfei Yu, Liang Ye, Wenyan Wang, Chunjie Sha, Huijie Yang, Yingjie Yang, Yunjing Zhu, Lin Dong, Shujuan Wei, Linlin Wang, Jingwei Tian, Hongbo Wang
EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY. 2023 Nov 08 .
影响因子: 6.7
- Deubiquitinase OTUB1 regulates doxorubicin-induced cardiotoxicity via deubiquitinating c-MYC
Fei Xu, Tongtong Zang, Han Chen, Changyi Zhou, Rui Wang, Yue Yu, Li Shen, Juying Qian, Junbo Ge
CELLULAR SIGNALLING. 2023 Oct 21 .
影响因子: 4.8
- WTAP boosts lipid oxidation and induces diabetic cardiac fibrosis by enhancing AR methylation
Kai Song, He Sun, Bin Tu, Yang Zhou, Li-Chan Lin, Zhi-Yan Liu, Rui Li, Jing-Jing Yang, Ye Zhang, Jian-Yuan Zhao, Hui Tao
iScience. 2023 Oct 20 .
影响因子: 5.8
- ELP2-NLRP3-GSDMD/GSDME-mediated pyroptosis is induced by TNF-α in MC3T3-E1 cells during osteogenic differentiation
Changliang Xia, Shuanji Ou, Yang Yang, Wei Zhang, Wenjiao Wu, Qi Chen, Wenjun Li, Hanyu Lu, Yeyang Wang, Yong Qi, Changpeng Xu
JOURNAL OF CELLULAR AND MOLECULAR MEDICINE. 2023 Oct 13 .
影响因子: 5.3
- FOXA1/MND1/TKT axis regulates gastric cancer progression and oxaliplatin sensitivity via PI3K/AKT signaling pathway
Hu Xiaosi, Zhou Shuai, Li Haohao, Wu Zehui, Wang Ye, Meng Lei, Chen Zhangming, Wei Zhijian, Pang Qing, Xu Aman
Cancer Cell International. 2023 Oct 10 .
影响因子: 5.8
- O-GlcNAcylation of TLR4 inhibits osteogenic differentiation of periodontal ligament stem cells
Bohan Yu, Qin Li, Xi Sun, Yue Yin
JOURNAL OF PERIODONTAL RESEARCH. 2023 Oct 10 .
影响因子: 3.5
- An ultrathin Zn-based layered double hydroxides augment degradation of mutant p53 to improve tumor therapy
Gongxi Qiao, Xuming Pan, Mengyun He, Ruixi Peng, Xiangrong Huang, Cunpeng Nie, Jianhui Jiang, Xia Chu
CHEMICAL ENGINEERING JOURNAL. 2023 Oct 06 .
影响因子: 15.1
- LZTS3/TAGLN Suppresses Cancer Progression in Human Colorectal Adenocarcinoma Through Regulating Cell Proliferation, Migration, and Actin Cytoskeleton
Xinpei Gu, Shuhui Chen, Zhaojin Wang, Qianwen Bu, Shuhong An
ARCHIVES OF MEDICAL RESEARCH. 2023 Oct 06 .
影响因子: 7.7
- Cyclovirobuxine D alleviates aldosterone-induced myocardial hypertrophy by protecting mitochondrial function depending on the mutual regulation of Nrf2-SIRT3
Xueting Wang, Hongkun Wu, Jiangfei An, Guangqiong Zhang, Yan Chen, Lingyun Fu, Ling Tao, Guiyou Liang, Xiangchun Shen
BIOMEDICINE & PHARMACOTHERAPY. 2023 Oct 02 .
影响因子: 7.5
- Cerebral endothelial cell-derived extracellular vesicles regulate microglial polarization and promote autophagy via delivery of miR-672-5p
Wang Changshui, Feng Lei, Zhu Li, Wu Linlin, Chen Beibei, Cui Changmeng, Yang Mengqi, Gao Yahao, Jiang Pei
Cell Death & Disease. 2023 Sep 29 .
影响因子: 9
- MRE11:p.K464R mutation mediates olaparib resistance by enhancing DNA damage repair in HGSOC
Xucui Zhuang, Rourou Xiao, Yu Fu, Bin Yang, Junpeng Fan, Funian Lu, Tianyu Qin, Xiaohang Yang, Xingyuan Hu, Jingjing Yin, Wenting Li, Xiaoyan Kang, Gang Chen, Dianxing Hu & Chaoyang Sun
Cell & Bioscience. 2023 Sep 27 .
影响因子: 7.5
- FTO attenuates the cytotoxicity of cisplatin on KGN cells by regulating the Hippo/YAP1 signaling pathway
Rongli Wang, Xinyuan Yang
Research Square. 2023 Sep 26 .
- mIgM-mediated splenic marginal zone B cells targeting of folic acid for immunological evasion
Acta Pharmaceutica Sinica B
Acta Pharmaceutica Sinica B. 2023 Sep 26 .
影响因子: 14.5
- Sirtuin 5 Alleviates Liver Ischemia/Reperfusion Injury by Regulating Mitochondrial Succinylation and Oxidative Stress
Yan Hu, Xinyao Tian, Yan Zhao, Zhecheng Wang, Musen Lin, Ruimin Sun, Yue Wang, Zhanyu Wang, Guiru Li, Shusen Zheng, and Jihong Yao
Antioxidants & Redox Signaling. 2023 Sep 21 .
影响因子: 6.6
- High-intensity interval training induces lactylation of fatty acid synthase to inhibit lipid synthesis
Xuefei Chen, Wenhua Huang, Jingbo Zhang, Yanjun Li, Zheng Xing, Lanlan Guo, Hongfeng Jiang & Jing Zhang
BMC Biology. 2023 Sep 19 .
影响因子: 5.4
- Fibrinogen-like protein 2 regulates macrophage glycolytic reprogramming by directly targeting PKM2 and exacerbates alcoholic liver injury
Xue Hu, Xiaoyang Wan, Yuting Diao, Zhe Shen, Zhongwei Zhang, Peng Wang, Danqin Hu, Xiaojing Wang, Weiming Yan, Chaohui Yu, Xiaoping Luo, Hongwu Wang, Qin Ning
INTERNATIONAL IMMUNOPHARMACOLOGY. 2023 Sep 19 .
影响因子: 5.6
- CircXRN2 suppresses tumor progression driven by histone lactylation through activating the Hippo pathway in human bladder cancer
Xie Bo, Lin Juntao, Chen Xianwu, Zhou Xuejian, Zhang Yan, Fan Mengjing, Xiang Jiayong, He Ning, Hu Zhenghui, Wang Feifan
Molecular Cancer. 2023 Sep 08 .
影响因子: 37.3
- Zyxin inhibits the epithelial–mesenchymal transition process in gastric cancer by upregulating SIRT1
Jing Lou, Sha Geng, Wei He, Song-Bai Liu, Xinghong Shi, Ying Chang, Shiyuan Han, Panting Qian, Hesham M Amin, Yao-Hua Song, Yangxin Li, Jin Zhou
MedComm. 2023 Sep 03 .
影响因子: 9.9
- 14-3-3ζ targets β-catenin nuclear translocation to maintain mitochondrial homeostasis and promote the balance between proliferation and apoptosis in cisplatin-induced acute kidney injury
Zhaoxing Sun, Yichun Ning, Huan Wu, Shulan Guo, Xiaoyan Jiao, Ji Ji, Xiaoqiang Ding, Xiaofang Yu
CELLULAR SIGNALLING. 2023 Aug 30 .
影响因子: 4.8
- Quantitative proteomic and phosphoproteomic analysis reveal the relationship between mitochondrial dysfunction and cytoskeletal remodeling in hiPSC-CMs deficient in PINK1
Liu Huiwen, Wang Li, Xu Hao, Tan Bin, Yi Qin, Deng Hongrong, Chen Yunxia, He Bolin, Tian Jie, Zhu Jing
Journal of Translational Medicine. 2023 Aug 30 .
影响因子: 7.4
- 4-phenylbutyric acid re-trafficking hERG/G572R channel protein by modulating the endoplasmic reticulum stress-associated chaperones and endoplasmic reticulum-associated degradation gene
Wen Tang, Dihui Cai, Yin Fu, Zequn Zheng, Xiaoyan Huang, Rami N. Khouzam, Yongfei Song, Jiangfang Lian
Journal of Thoracic Disease. 2023 Aug 28 .
影响因子: 2.5
- Mitochondrial oxidative stress regulates LonP1-TDP-43 pathway and rises mitochondrial damage in carbon tetrachloride-induced liver fibrosis
Shulin Shan, Zhidan Liu, Shuai Wang, Zhaoxiong Liu, Shihua Chao, Cuiqin Zhang, Ming Li, Fuyong Song
ECOTOXICOLOGY AND ENVIRONMENTAL SAFETY. 2023 Aug 28 .
影响因子: 6.8
- Forsythiaside A alleviates acute lung injury by inhibiting inflammation and epithelial barrier damages in lung and colon through PPAR-γ/RXR-α complex
Jing Wang, Xinyan Xue, Xingtao Zhao, Lin Luo, Juan Liu, Shu Dai, Fang Zhang, Rui Wu, Yanfang Liu, Cheng Peng, Yunxia Li
Journal of Advanced Research. 2023 Aug 12 .
影响因子: 10.7
- Hsa_circ_0009092/miR-665/NLK signaling axis suppresses colorectal cancer progression via recruiting TAMs in the tumor microenvironment
Jialin Song,Qing Liu, Lei Han, Tiantian Song, Sihao Huang, Xinyao Zhang, Qiuming He, Chenxi Liang, Shuai Zhu, Bin xiong
Research Square. 2023 Aug 07 .
- SIRT5 alleviates liver ischemia/reperfusion injury by regulating mitochondrial succinylation and oxidative stress
Prof. Jihong Yao,Yan Hu,Dr. Xinyao Tian,Dr. Yan Zhao,Dr. Zhecheng Wang,Ms. Musen Lin,Dr. Ruimin Sun,Dr. Yue Wang,Dr. Zhanyu Wang,Prof. Guiru Li,Prof. Shusen Zheng
ANTIOXIDANTS & REDOX SIGNALING. 2023 Jul 29 .
影响因子: 6.6
- Disruption of RCAN1.4 expression mediated by YY1/HDAC2 modulates chronic renal allograft interstitial fibrosis
Zhang Jianjian,Zhang Yao,Feng Dengyuan,Zhou Hai,Gui Zeping,Zheng Ming,Hang Zhou,Gu Min,Tan Ruoyun
Cell Death Discovery. 2023 Jul 28 .
影响因子: 7
- PFDN2 promotes cell cycle progression via the hnRNPD-MYBL2 axis in gastric cancer
Qiuming He, Zheyu Ding, Tingna Chen, Haitao Wu, Jialing Song, Zhenxian Xiang, Chaogang Yang, Shuyi Wang, Bin Xiong
Frontiers in Oncology. 2023 Jul 18 .
影响因子: 4.7
- Lysine N-methyltransferase SETD7 promotes bladder cancer progression and immune escape via STAT3/PD-L1 cascade
Jiancheng Lv,Qikai Wu,Kai Li,Kexin Bai,Hao Yu,Juntao Zhuang,Huanyou Sun,Haiwei Yang,Xiao Yang,Qiang Lu
International Journal of Biological Sciences. 2023 Jul 16 .
影响因子: 9.2
- Astrocyte-derived SerpinA3N promotes neuroinflammation and epileptic seizures by activating the NF-κB signaling pathway in mice with temporal lobe epilepsy
Liu Chong,Zhao Xue-Min,Wang Qiao,Du Ting-Ting,Zhang Mo-Xuan,Wang Hui-Zhi,Li Ren-Peng,Liang Kun,Gao Yuan,Zhou Si-Yu,Xue Tao,Zhang Jian-Guo,Han Chun-Lei,Shi Lin,Zhang Liang-Wen,Meng Fan-Gang
Journal of Neuroinflammation. 2023 Jul 08 .
影响因子: 9.3
- Increased IP3R-3 degradation induced by acrylamide promoted Ca2+-dependent calpain activation and axon damage in rats
Shuai Wang, Yiyu Yang, Shulin Shan, Zhengcheng Huang, Zhaoxiong Liu, Hui Yong, Zhidan Liu, Cuiqin Zhang, Fuyong Song
TOXICOLOGY LETTERS. 2023 Jun 21 .
影响因子: 3.5
- Splicing factor TRA2A contributes to esophageal cancer progression via a noncanonical role in lncRNA m6A methylation
Mingrong Bei, Shijia Hao, Kai Lin, Qiuyang Chen, Yujie Cai, Xing Zhao, Leiming Jiang, Lirui Lin, Geng Dong, Jianzhen Xu
CANCER SCIENCE. 2023 Jun 14 .
影响因子: 5.7
- Wnt5a高表达通过β-catenin/TCF4/Cx43轴参与心肌细胞缺氧复氧损伤的作用及其机制研究
董官林
南昌大学. 2023 Jun 05 .
- A novel protein encoded by circUBE4B promotes progression of esophageal squamous cell carcinoma by augmenting MAPK/ERK signaling
Lyu Yingcheng, Tan Binghua, Li Lin, Liang Ruihao, Lei Kai, Wang Kefeng, Wu Duoguang, Lin Huayue, Wang Minghui
Cell Death & Disease. 2023 Jun 01 .
影响因子: 9
- DNMT3a-mediated methylation of TCF21/hnRNPA1 aggravates hepatic fibrosis by regulating the NF-κB signaling pathway
Liangyun Li, Shaoxi Diao, Zixiang Chen, Jintong Zhang, Wei Chen, Tianqi Wang, Xin Chen, Yuxin Zhao, Tao Xu, Cheng Huang, Jun Li
PHARMACOLOGICAL RESEARCH. 2023 Jun 01 .
影响因子: 9.3
- Trigred motif 36 regulates neuroendocrine differentiation of prostate cancer via HK2 ubiquitination and GPx4 deficiency
Xusong Zhao, Tianren Zhou, Yuhao Wang, Meiling Bao, Chenbo Ni, Lei Ding, Shengjie Sun, Huiyu Dong, Jie Li, Chao Liang
Cancer Sci. 2023 Jun 01 .
影响因子: 5.7
- 基于SIRT1/NF-κB通路探讨指压法调节肥胖胰岛素抵抗状态的炎性作用机制研究
高天姣
长春中医药大学. 2023 Jun 01 .
- Amelioratory effects of Astragaloside IV on hepatocarcinogenesis via Nrf2-mediated pSmad3C/3L transformation
Yong- Fang Gong, Shu Hou, Jia-Cheng Xu, Yan Chen, Le-Le Zhu, Ying-Ying Xu, Yu-Qing Chen, Miao-Miao Li, Li-Li Li, Jing-Jing Yang, Yan Yang
PHYTOMEDICINE. 2023 May 29 .
影响因子: 6.656
- Hepatic glucuronyl C5-epimerase combats obesity by stabilising GDF15
Fei He, Haowen Jiang, Chang Peng, Tingting Wang, Rongrong Xiao, Meilin Chen, Nixue Song, Zhenyun Du, Hanlin Wang, Xiaoyu Ding, Yikai Shao, Jianping Fang, Yi Zang, Rong Hua, Jia Li, Kan Ding
JOURNAL OF HEPATOLOGY. 2023 May 20 .
影响因子: 25.7
- 环状RNA ARSB在肝细胞癌进展中的功能和机制研究
王伟军
中国人民解放军海军军医大学. 2023 May 01 .
- Rasd2对慢性不可预知应激小鼠抑郁样行为的影响及其机制研究
程子倩
吉林大学. 2023 May 01 .
- RNF41泛素化修饰TTC1激活Ras-ERK信号通路促进胆管癌增殖和转移的分子机制
张瑜
昆明医科大学. 2023 May 01 .
- G Protein-Coupled Receptor 120 Mediates Host Defense against Clostridium perfringens Infection through Regulating NOD-like Receptor Family Pyrin Domain-Containing 3 Inflammasome Activation
Yang Liu, Yu-Xin Lei, Jian-Wei Li, Yu-Ze Ma, Xue-Yin Wang, Fan-Hua Meng, Yu-Jing Wu, Na Wang, Jing Liang, Cai-Quan Zhao, Yang Yang, Guang-Xin Chen, Shui-Xing Yu
JOURNAL OF AGRICULTURAL AND FOOD CHEMISTRY. 2023 Apr 28 .
影响因子: 5.895
- 转录因子EB在镉致急性肾损伤中的作用研究
董鹏飞
山东农业大学. 2023 Apr 06 .
- PLAGL2 promotes Snail expression and gastric cancer progression via UCA1/miR-145-5p/YTHDF1 axis
Chen Wen, He Qunjun, Liu Jingjing, Li Ni, Xiao Kai, Chen Honghui
CARCINOGENESIS. 2023 Mar 31 .
影响因子: 4.741
- Hypoxia-induced degradation of PICK1 by RBCK1 promotes the proliferation of nasopharyngeal carcinoma cells
Yingzi Zhang, Yue Lu, Yiqing Xu, Ziyu Le, Yi Liu, Wenzhi Tu, Yong Liu
LIFE SCIENCES. 2023 Mar 18 .
影响因子: 6.78
- BRD4 promotes hepatic stellate cells activation and hepatic fibrosis via mediating P300/H3K27ac/PLK1 axis
Miao Cheng, Juan-juan Li, Xue-ni Niu, Lin Zhu, Jin-yu Liu, Peng-cheng Jia, Sai Zhu, Hong-wu Meng, Xiong-wen Lv, Cheng Huang, Jun Li
BIOCHEMICAL PHARMACOLOGY. 2023 Mar 11 .
影响因子: 6.1
- Glyphosate-induced autophagy inhibition results in hepatic steatosis via mediating epigenetic reprogramming of PPARα in roosters
Cai-Yu Lian, Sheng Wei, Zi-Fa Li, Shu-Hui Zhang, Zhen-Yong Wang, Lin Wang
ENVIRONMENTAL POLLUTION. 2023 Mar 09 .
影响因子: 9.988
- ZNF692招募PRMT1介导IL7R表达上调在JAK3/STAT3通路激活和乳腺癌细胞增殖转移中的机制研究
张文武
广州中医药大学. 2023 Mar 01 .
- 线粒体泛素连接酶1调控缺氧心肌细胞的作用研究
徐方晶
宁夏医科大学. 2023 Mar 01 .
- m6A去甲基化酶ALKBH5调控Drp1介导的线粒体裂变在肝纤维化中的作用及其机制
王娟
安徽医科大学. 2023 Mar 01 .
- Galectin-9 and PD-L1 antibody blockade combination therapy inhibits tumour progression in pancreatic cancer
Enliang Li, Jian Xu, Qi Chen, Xiaozhen Zhang, Xingyuan Xu, Tingbo Liang
Immunotherapy. 2023 Feb 13 .
影响因子: 4.04
- DNMT3a-dermatopontin axis suppresses breast cancer malignancy via inactivating YAP
Ye Danrong, Wang Yuying, Deng Xiaochong, Zhou Xiqian, Liu Diya, Zhou Baian, Zheng Wenfang, Wang Xuehui, Fang Lin
Cell Death & Disease. 2023 Feb 11 .
影响因子: 9.685
- Human umbilical cord mesenchymal stem cell exosome-derived miR-874-3p targeting RIPK1/PGAM5 attenuates kidney tubular epithelial cell damage
Yu, Yihang, Chen, Meiling, Guo, Qitong, Shen, Lianju, Liu, Xing, Pan, Jianbo, Zhang, Yuanyuan, Xu, Tao, Zhang, Deying, Wei, Guanghui
CELLULAR & MOLECULAR BIOLOGY LETTERS. 2023 Feb 07 .
影响因子: 8.702
- Lysine 222 in PPAR γ1 functions as the key site of MuRF2-mediated ubiquitination modification
Fan Yucheng, Xu Fangjing, Wang Rui, He Jun
Scientific Reports. 2023 Feb 03 .
影响因子: 4.996
- Inhibition of mGluR5/PI3K-AKT Pathway Alleviates Alzheimer’s Disease-Like Pathology Through the Activation of Autophagy in 5XFAD Mice
Chen Yuzhao, Zhang Yilin, Chen Qiuxuan, Liu Yuxiang, Wei Xuemin, Wu Meijian, Zhang Keke, Liu Yinghu, Wei Wei
Journal of Alzheimer's Disease. 2023 Jan 31 .
影响因子: 4
- Baicalein limits osteoarthritis development by inhibiting chondrocyte ferroptosis
Yunpeng Wan, Kai shen, Haiyang Yu, Weimin Fan
FREE RADICAL BIOLOGY AND MEDICINE. 2023 Jan 16 .
影响因子: 8.101
- PAK1 Is Involved in the Spindle Assembly during the First Meiotic Division in Porcine Oocytes
Lei Peng, Yijing He, Weihan Wang, Yajie Chu, Qixin Lin, Rong Rui, Qiao Li, Shiqiang Ju
INTERNATIONAL JOURNAL OF MOLECULAR SCIENCES. 2023 Jan 06 .
影响因子: 6.208
- MALT1 promotes necroptosis in stroke rat brain via targeting the A20/RIPK3 pathway
Zi-Mei Peng, Yi-Yue Zhang, Dan Wei, Xiao-Jie Zhang, Bin Liu, Jun Peng, Xiu-Ju Luo
ARCHIVES OF BIOCHEMISTRY AND BIOPHYSICS. 2023 Jan 02 .
影响因子: 4.114
- Inhibition of IGF2BP1 attenuates renal injury and inflammation by alleviating m6A modifications and E2F1/MIF pathway
Mao, Yan;Jiang, Feng;Xu, Xue-Jiao;Zhou, Lan-Bo;Jin, Rui;Zhuang, Li-Li;Juan, Chen-Xia;Zhou, Guo-Ping
International Journal of Biological Sciences. 2023 Jan 01 .
影响因子: 10.75
- SIRT3 promotes metabolic maturation of human iPSC-derived cardiomyocytes via OPA1-controlled mitochondrial dynamics
Rui Wang, Hao Xu, Bin Tan, Qin Yi, Yanting Sun, Han Xiang, Tangtian Chen, Huiwen Liu, Qiumin Xie, Li Wang, Jie Tian, Jing Zhu
FREE RADICAL BIOLOGY AND MEDICINE. 2022 Dec 31 .
影响因子: 8.101
- Rasd2 mediates acute fasting-induced antidepressant-like effects via dopamine D2 receptor activation in ovariectomized mice
Cheng Ziqian, Zhao Fangyi, Piao Jingjing, Cui Ranji, Li Bingjin
INTERNATIONAL JOURNAL OF NEUROPSYCHOPHARMACOLOGY. 2022 Dec 25 .
影响因子: 5.678
- Diesel exhaust PM2.5 greatly deteriorates fibrosis process in pre-existing pulmonary fibrosis via ferroptosis
Dayong Yue, Qian Zhang, Jinjin Zhang, Weili Liu, Libang Chen, Meirong Wang, Rongrong Li, Song Qin, Xiaodong Song, Yunxia Ji
ENVIRONMENT INTERNATIONAL. 2022 Dec 19 .
影响因子: 13.352
- The Weakened Interaction Between HECTD4 and GluN2B in Ischemic Stroke Promotes Calcium Overload and Brain Injury Through a Mechanism Involving the Decrease of GluN2B and MALT1 Ubiquitination
Zhang, Yi-Yue, Yang, Xiao-Yan, Liu, Hui-Qi, Zhang, Zheng, Hu, Chang-Ping, Peng, Jun, Luo, Xiu-Ju
MOLECULAR NEUROBIOLOGY. 2022 Dec 17 .
影响因子: 5.682
- 父系孕前壬基酚暴露致F1雄性后代肝脏损伤及表观遗传机制研究
邸倩南
东南大学. 2022 Nov 30 .
- The lipid transporter HDLBP promotes hepatocellular carcinoma metastasis through BRAF-dependent epithelial-mesenchymal transition
Jingsheng Yuan, Tao Lv, Jian Yang, Zhenru Wu, Lvnan Yan, Jiayin Yang, Yujun Shi, Li Jiang
Cancer Letters. 2022 Nov 28 .
影响因子: 9.756
- N6-methyladenosine plays a dual role in arsenic carcinogenesis by temporal-specific control of core target AKT1
Tianhe Zhao, Donglei Sun, Wenxiao Xiong, Jin Man, Qian Zhang, Manyu Zhao, Zunzhen Zhang
JOURNAL OF HAZARDOUS MATERIALS. 2022 Nov 24 .
影响因子: 14.224
- HDLBP-stabilized lncFAL inhibits ferroptosis vulnerability by diminishing Trim69-dependent FSP1 degradation in hepatocellular carcinoma
Jingsheng Yuan, Tao Lv, Jian Yang, Zhenru Wu, Lvnan Yan, Jiayin Yang, Yujun Shi
Redox Biology. 2022 Nov 19 .
影响因子: 10.787
- SGOL2 is a novel prognostic marker and fosters disease progression via a MAD2-mediated pathway in hepatocellular carcinoma
Hu, Qingqing, Liu, Qiuhong, Zhao, Yalei, Zhang, Lingjian, Li, Lanjuan
Biomarker Research. 2022 Nov 15 .
影响因子: 8.633
- NEIL3 contributes to the Fanconi anemia/BRCA pathway by promoting the downstream double-strand break repair step
Niu Li, Yufei Xu, Hongzhu Chen, Lina Chen, Yi Zhang, Tingting Yu, Ruen Yao, Jing Chen, Qihua Fu, Jia Zhou, Jian Wang
Cell Reports. 2022 Nov 08 .
影响因子: 9.995
- HDLBP promotes hepatocellular carcinoma proliferation and sorafenib resistance by suppressing Trim71-dependent RAF1 degradation
Jingsheng Yuan, Tao Lv, Jian Yang, Zhenru Wu, Lvnan Yan, Jiayin Yang, Yujun Shi, Li Jiang
Cellular and Molecular Gastroenterology and Hepatology. 2022 Oct 14 .
影响因子: 8.797
- RBM3 interacts with Raptor to regulate autophagy and protect cardiomyocytes from ischemia–reperfusion-induced injury
Wang, Nan, Wang, Limeiting, Li, Changyan, Rao, Peng, Wang, Xun, Xu, Yazhou, Yang, Lin, Sun, Lin, Lu, Di
JOURNAL OF PHYSIOLOGY AND BIOCHEMISTRY. 2022 Oct 04 .
影响因子: 5.08
- The SPATA2/CYLD pathway contributes to doxorubicin-induced cardiomyocyte ferroptosis via enhancing ferritinophagy
Yuan-Jing Zhou, Dan-Qing Duan, Li-Qun Lu, Li-Jing Tang, Xiao-Jie Zhang, Xiu-Ju Luo, Jun Peng
CHEMICO-BIOLOGICAL INTERACTIONS. 2022 Oct 01 .
影响因子: 5.168
- Postprandial triglyceride-rich lipoproteins promote the adipogenic differentiation of adipose-derived mesenchymal stem cells via the LRP1/caveolin-1/AKT1 pathway
Qunyan Xiang, Feng Tian, Jin Xu, Xiao Du, Shilan Zhang, Liling Guo, Liyuan Zhu, Yingying Xie, Xueyan Zang, Yajun Gui, Tie Wen, Ling Liu
. 2022 Sep 27 ; BIOCHIMICA ET BIOPHYSICA ACTA-MOLECULAR AND CELL BIOLOGY OF LIPIDS
影响因子: 5.228
- CircSEMA4B inhibits the progression of breast cancer by encoding a novel protein SEMA4B-211aa and regulating AKT phosphorylation
Xuehui Wang, Wei Jian, Qifeng Luo, Lin Fang
Cell Death & Disease. 2022 Sep 17 .
影响因子: 9.685
- GLP-1 regulates exercise endurance and skeletal muscle remodeling via GLP-1R/AMPK pathway
Luting Wu, Min Zhou, Tianyou Li, Niu Dong, Long Yi, Qianyong Zhang, Mantian Mi
Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 2022 Sep 01 ; 9
影响因子: 4.739
- Sequestered SQSTM1/p62 crosstalk with Keap1/NRF2 axis in hPDLCs promotes oxidative stress injury induced by periodontitis
Huiqing Gou, Xu Chen, Xiaoming Zhu, Lu Li, Liguang Hou, Yi Zhou, Yan Xu
Free Radical Biology and Medicine. 2022 Sep 01 .
影响因子: 8.101
- TPX2 deficiency leads to spindle abnormity and meiotic impairment in porcine oocytes
Yijing He, Lei Peng, Jia Li, Qiao Li, Yajie Chu, Qixin Lin, Rong Rui, Shiqiang Ju
Theriogenology. 2022 Jul 15 .
影响因子: 2.7
- The Novel Protein ADAMTS16 Promotes Gastric Carcinogenesis by Targeting IFI27 through the NF-κb Signaling Pathway
Tuoyang Li, Junyi Zhou, Yingming Jiang, Yandong Zhao, Jintuan Huang, Weiyao Li, Zhenze Huang, Zijian Chen, Xiaocheng Tang, Hao Chen, Zuli Yang
research square. 2022 Jul 08 .
- HIF‑1α and MBP1 are associated with the progression of breast cancer cells by repressing β‑catenin transcription
Ying Zhuang, Xiang Li, Peng Zhan, Guoliang Pi, Gu Wen
Oncology Reports. 2022 Jul 05 .
影响因子: 4.136
- Cold Atmospheric Plasma Conveys Selectivity Against Hepatocellular Carcinoma Cells via Triggering EGFR(Tyr1068)-Mediated Autophagy
Danjun Wang, Jianying Zhang, Linhan Cai, Xiaofeng Dai
Frontiers in Oncology. 2022 Jul 04 .
影响因子: 5.738
- SIK2 promotes ovarian cancer cell motility and metastasis by phosphorylating MYLK
Xiu Shi, 1 , 2 , 3 Xuejiao Yu, 4 Juan Wang, 1 Shimin Bian, 1 Qiutong Li, 1 Fengqing Fu, 2 , 3 Xinwei Zou, Lin Zhang, Robert C. Bast, Jr., Zhen Lu, Lingchuan Guo, Youguo Chen, Jinhua Zhou
Molecular Oncology. 2022 Jul 01 ; 13
影响因子: 7.449
- 兰州市城区大气PM2.5对心血管疾病入院人数的影响及对心肌细胞损伤机制研究
吴婷婷
兰州大学. 2022 Jul 01 .
- Colchicine Ameliorates Dilated Cardiomyopathy Via SIRT2‐Mediated Suppression of NLRP3 Inflammasome Activation
Xuan Sun, Junfeng Duan, Chenyi Gong, Yuting Feng, Jiaxin Hu, Rong Gu and Biao Xu
Journal of the American Heart Association. 2022 Jun 29 ; 13
影响因子: 6.106
- The Intracellular Interaction of Porcine b-Defensin 2 with VASH1 Alleviates Inflammation via Akt Signaling Pathway
Chao Huang, Yufan Sun, Xiuxiu Qiu, Jing Huang, Antian Wang, Qiuhong Zhang, Siqi Pang, Qi Huang, Rui Zhou, Lu Li
JOURNAL OF IMMUNOLOGY. 2022 Jun 15 ; 12
影响因子: 5.426
- USP14调控OSBPL2蛋白去泛素化作用的实验研究
张洪都;王红顺;王天明;姚俊;曹新
南京医科大学学报(自然科学版). 2022 Jun 14 .
- Integrating Network Pharmacology and Experimental Validation to Explore the Key Mechanism of Gubitong Recipe in the Treatment of Osteoarthritis
Guang-yao Chen , Xiao-yu Liu , Jing Luo , Xin-bo Yu , Yi Liu , Qing-wen Tao
Computational and Mathematical Methods in Medicine. 2022 Jun 08 .
影响因子: 1.77
- High Mobility Group Protein B1 Decreases Surface Localization of PD-1 to Augment T-cell Activation
Qun Gao, Shumin Wang, Feng Li, Jingyao Lian, Shaoyan Cheng, Dongli Yue, Zhen Zhang. Shasha Liu. Feifei Ren. Daiqun Zhang. Shengdian Wang. Liping Wang. Yi Zhang
Cancer Immunol Res. 2022 Jun 07 .
影响因子: 11.151
- Penehyclidine hydrochloride suppresses inflammation response and reduces podocyte injury in diabetic nephropathy by targeting fibrinogen-like protein 2
Hong-Bao Tan, Qian Zhao, Li Chen
International Immunopharmacology. 2022 Jun 01 .
影响因子: 3.943
- 三阴型乳腺癌干细胞分子特征探索及关键基因ATP6V1B1与TGFBR2功能研究
张智发
江南大学. 2022 Jun 01 .
- STK/STP调控猪链球菌生长和细胞分裂的分子机制
胡巧
华中农业大学. 2022 Jun 01 .
- PM2.5-Induced Programmed Myocardial Cell Death via mPTP Opening Results in Deteriorated Cardiac Function in HFpEF Mice
Tingting Wu, Minghui Tong, Aiai Chu, Kaiyue Wu, Xiaowei Niu, Zheng Zhang
Cardiovascular Toxicology. 2022 May 20 .
影响因子: 3.02
- Novel Insights into the Cardioprotective Effects of Calcitriol in Myocardial Infarction
Simin Yang,Chunmiao Wang,Chengshao Ruan,Meiling Chen,Ran Cao,Liang Sheng,Naiying Chang,Tong Xu,Peiwen Zhao,Xuesheng Liu,Fengqin Zhu,Qingzhong Xiao, Shan Gao
Cells. 2022 May 18 ; 10
影响因子: 6.534
- E3连接酶TRIM9泛素化修饰Beclin1调节自噬缓解心肌缺血再灌注损伤
王丽梅亭
昆明医科大学. 2022 May 01 .
- miR-509-5p通过靶向TRIB2和激活AP4/p21通路抑制骨肉瘤生物学行为的机制研究
郭杰坤
南方医科大学. 2022 May 01 .
- NNMT调控鼻咽癌细胞的生物学行为和放射敏感性的作用机制研究
李玲玲
华中科技大学. 2022 May 01 .
- 热疗增强卵巢癌细胞对化疗药物和PARP抑制剂敏感性机制研究
孙桦婷
苏州大学. 2022 May 01 .
- 慢性间歇性低压低氧通过促进铁自噬改善代谢综合征大鼠肝脏损伤的机制研究
米海潮
河北医科大学. 2022 Mar 01 .
- HSPB1调控铁死亡影响食管癌放疗敏感性机制研究
徐思琦
中国医科大学. 2022 Mar 01 .
- 从VEGF诱导的SphK1过度转位探讨栀子苷抑制RA血管新生作用机制
王言
安徽中医药大学. 2022 Mar 01 .
- 泛素连接酶MuRF2修饰PPAR γ1位点的初步研究
范玉成
宁夏医科大学. 2022 Mar 01 .
- miR-103a-3p Silencing Ameliorates Calcium Oxalate Deposition in Rat Kidney by Activating the UMOD/TRPV5 Axis
Zenglin Cui, Yuwei Li, Gaorui Liu, Yanmeng Jiang
Disease Markers. 2022 Feb 23 .
影响因子: 3.4
- MYCT1 alters the glycogen shunt by regulating selective translation of RACK1-mediated enzymes
Dong-Xue Ding, Yue Wang, Wei Yan, Wei-Neng Fu
iScience. 2022 Feb 22 .
影响因子: 4.447
- Spexin ameliorates skeletal muscle insulin resistance through activation of GAL2 receptor
Mei Yua, Mengyuan Wanga, Shiyu Han, Long Han, Yue Kan, Juan Zhao, Xizhong Yu, Jing Yan, Yu Jin, Zhenwen Zhang, Wenbing Shang, Penghua Fang
European Journal of Pharmacology. 2022 Feb 15 .
影响因子: 4.432
- Rapamycin attenuated podocyte apoptosis via upregulation of nestin in Ang II-induced podocyte injury
Huimin Shi, Yajie Zhao, Tiantian He, Xianli Wen, Gaoting Qu, Shanwen Li, Weihua Gan, Aiqing Zhang
Molecular Biology Reports. 2022 Feb 11 .
影响因子: 2.293
- Bone Mesenchymal Stem Cell-Derived Exosome-Enclosed miR-181a Induces CD4+CD25+FOXP3+ Regulatory T Cells via SIRT1/Acetylation-Mediated FOXP3 Stabilization
Renyong Wang , Ruixue Li, Tiehan Li, Lei Zhu, Zongze Qi, Xiaokui Yang, Huan Wang, Baoquan Cao, Hong Zhu
Journal of Oncology. 2022 Jan 11 .
影响因子: 4.375
- Sodium-Glucose Co-transporter-2 Inhibitor of Dapagliflozin Attenuates Myocardial Ischemia/Reperfusion Injury by Limiting NLRP3 Inflammasome Activation and Modulating Autophagy
Yong-Wei Yu, Jia-Qun Que, Shuai Liu, Kai-Yu Huang, Lu Qian, Ying-Bei Weng, Fang-Ning Rong, Lei Wang, Ying-Ying Zhou, Yang-Jing Xue, Kang-Ting Ji
Frontiers in Cardiovascular Medicine. 2022 Jan 10 .
影响因子: 4.79
- EGLN1 induces tumorigenesis and radioresistance in nasopharyngeal carcinoma by promoting ubiquitination of p53 in a hydroxylase-dependent manner
Lu Sun, Cheng Wu, Jun Ming, Ergang Guo, Wei Zhang, Lingling Li, Guoqing Hu
Journal of Cancer. 2022 Jan 10 ; 7
影响因子: 4.207
- Sodium-Glucose Co-transporter-2 Inhibitor of Dapagliflozin Attenuates Myocardial Ischemia/Reperfusion Injury by Limiting NLRP3 Inflammasome Activation and Modulating Autophagy
Yong-Wei Yu, Jia-Qun Que, Shuai Liu, Kai-Yu Huang, Lu Qian, Ying-Bei Weng, Fang-Ning Rong, Lei Wang, Ying-Ying Zhou, Yang-Jing Xue, Kang-Ting Ji
Frontiers in Cardiovascular Medicine. 2022 Jan 10 .
影响因子: 6.05
- Harnessing chlorin e6 loaded by functionalized iron oxide nanoparticles linked with glucose for target photodynamic therapy and improving of the immunogenicity of lung cancer
Ting-Ting Yu, Xing-Chun Peng, Mei-Fang Wang, Ning Han, Hua-Zhen Xu, Qi-Rui Li, Liu-Gen Li, Xiang Xu, Qian-Li Ma, Bin Liu, Jue Wang, Li Zhao, Xiao Chen, Tong-Fei Li
Journal of Cancer Research and Clinical Oncology. 2022 Jan 08 .
影响因子: 4.553
- Baicalin protects against insulin resistance and metabolic dysfunction through activation of GALR2/GLUT4 signaling
Mei Yu,Shiyu Han,Mengyuan Wang,Long Han,Yujie Huang,PingBo,Penghua Fang ,ZhenwenZhang
Phytomedicine. 2022 Jan 01 .
影响因子: 5.34
- RNA-binding motif protein 10 represses tumor progression through the Wnt/β- catenin pathway in lung adenocarcinoma
Yingyue Cao, Jianxiong Geng, Xin Wang, Qingwei Meng, Shanqi Xu, Yaoguo Lang, Yongxu Zhou, Lishuang Qi, Zijie Wang, Zixin Wei, Yan Yu, Shi Jin, Bo Pan
International Journal of Biological Sciences. 2022 Jan 01 ; 1
影响因子: 6.58
- 肺栓塞患者血浆刺激HSP70和NOS表达的变化及意义
袁梦琪; 李东富; 龙春欢; 杨慧君
北华大学学报(自然科学版). 2021 Nov 10 .
- TK1通过TFDP1调控Wnt/β-catenin信号通路促进膀胱癌细胞增殖的研究
李科威
山东大学. 2021 Sep 10 .
- Cancer-Associated Fibroblasts Promote Vascular Invasion of Hepatocellular Carcinoma via Downregulating Decorin-integrin β1 Signaling
Xiaobo Zheng, Peng Wang, Li Li, Jing Yu, Chune Yu, Liangliang Xu, Lian Li, Fuzhen Dai, Lei Feng, Hong Zou, Xiaobo Chen6, Ming Zhang, Mingqing Xu
Frontiers in Cell and Developmental Biolog. 2021 Aug 24 .
影响因子: 5.186
- Mitochondria damage in ambient particulate matter induced cardiotoxicity: Roles of PPAR alpha/PGC-1 alpha signaling
Qixiao Jianga, Andong Jia, Daochuan Lib, Limei Shia, Mengyu Gaoa, Na Lvc, Ying Zhanga, Rong Zhangd, Rui Chene, Wen Chenb, Yuxin Zhenga, Lianhua Cui
Environmental Pollution. 2021 Aug 14 .
影响因子: 8.071
- Pannexin-1 promotes the invasion of pituitary adenoma by modulating ATP release
Xiaoshuang Tang
Research Square. 2021 Aug 12 .
- The role and mechanism of hyperoside against myocardial infarction in mice by regulating autophagy via NLRP1 inflammation pathway
YongkangYang,JingLi,TingcaiRao,ZhiruiFang,JunyanZhang
Journal of Ethnopharmacology. 2021 Aug 10 .
影响因子: 4.36
- Porcine beta-defensin 2 provides protection against bacterial infection by a direct bactericidal activity and alleviates inflammation via interference with the TLR4/NF-κB Pathway
Chao Huang, Xi Yang, Jing Huang, Xiao Liu, Xiaoyu Yang,Hui Jin, Qi Huang,Lu Li,Rui Zhou
Frontiers in Immunology. 2021 Jul 18 .
影响因子: 7.561
- Role and mechanism of chaperones calreticulin and ERP57 in restoring trafficking to mutant HERG‑A561V protein
Yujia Wu, Xiaoyan Huang, Zequn Zheng, Xi Yang, Yanna Ba, Jiangfang Lian
International Journal of Molecular Medicine. 2021 Jul 01 .
影响因子: 2.943
- 枸杞多糖促进小肠内分泌细胞分泌肠促胰液素
邓姝颖; 白莉莉; 薛阳; 陈康; 蔡慧珍
宁夏医科大学学报. 2021 Jun 30 .
- 脂联素受体在尼古丁导致脂肪内分泌功能紊乱中的作用及机制研究
高佳
山西医科大学. 2021 Jun 18 .
- Kindlin-2在膀胱癌中的表达及作用机制的研究
王天琦
青岛大学. 2021 Jun 17 .
- Upregulation of SGOL2 Predicts Poor Prognosis and Facilitates Hepatocellular Carcinoma Progression via Dysregulating the Cell Cycle by Directly Activating MAD2
Qingqing Hu, Xiaochu Hu, Yalei Zhao, Lingjian Zhang, Ya Yang, lanjuan li
Research Square. 2021 Jun 08 .
- LncRNA MIR99AHG/miR-136-5p/USP4/ACE2信号轴调控肺纤维化及其机制研究
李会
武汉科技大学. 2021 May 01 .
- RBM3结合Raptor调控自噬保护缺血复灌诱导的心肌细胞损伤
汪南
昆明医科大学. 2021 May 01 .
- UBE2D3通过促进p62泛素化调节自噬加重心肌缺血再灌注损伤
王勋
昆明医科大学. 2021 May 01 .
- The role of E26 transformation-specific variant transcription factor 5 in colorectal cancer cell proliferation and cell cycle progression
Yi Peng, Haoran Feng, Changgang Wang, Zijia Song, Yaqi Zhang, Kun Liu, Xi Cheng, Ren Zhao
Cell Death & Disease. 2021 Apr 30 .
影响因子: 5.989
- YY1-modulated long non-coding RNA SNHG12 promotes gastric cancer metastasis by activating the miR-218-5p/YWHAZ axis
Tianqi Zhang, Maneesh Kumarsing Beeharry, Zhenqiang Wang, Zhenggang Zhu, Jianfang Li, Chen Li
International Journal of Biological Sciences. 2021 Apr 12 ; 7
影响因子: 4.615
- USP15 participates in DBP-induced testicular oxidative stress injury through regulating the Keap1/Nrf2 signaling pathway
Lei Zhang, Xian Gao, Zhiqiang Qin, Xiaokai Shi, Kai Xu, Shangqian Wang, Min Tang, Wei Wang, Shengling Gao, Li Zuo, Lifeng Zhang, Wei Zhang
Science of The Total Environment. 2021 Apr 09 .
影响因子: 6.223
- Caspofungin suppresses brain cell necroptosis in the ischemic stroke rat via up-regulation of Pellino3
Yi-Yue Zhang, Jing Tian, Zi-Mei Peng, Ya-Wei Peng, Xiao-Jie Zhang, Zhong-Yang Hu, Xiu-Ju Luo, Jun Peng
Research Square. 2021 Mar 30 .
- 基于NLRP1炎症小体通路研究自噬在金丝桃苷抗小鼠心肌梗死中的作用及机制研究
杨永康
安徽医科大学. 2021 Mar 01 00:00:00 .
- MYCT1通过RACK1介导的酶选择性翻译调控糖原分流的机制研究
丁东雪
中国医科大学. 2021 Feb 01 .
- CENP-N/AKT1促进鼻咽癌细胞恶性生物学行为的作用及机制
祁承林
武汉大学. 2021 Feb 01 .
- Ubiquitin-specific protease 7 promotes ferroptosis via activation of the p53/TfR1 pathway in the rat hearts after ischemia/reperfusion
Li-Jing Tang, Yuan-Jing Zhou, Xiao-Ming Xiong, Nian-Sheng Li, Jie-Jie Zhang, Xiu-Ju Luo, Jun Peng
Free Radical Biology and Medicine. 2021 Jan 01 .
影响因子: 7.376
- Comprehensive analysis of ubiquitin‐specific protease 1 reveals its importance in hepatocellular carcinoma
Yalei Zhao, Chen Xue, Zhongyang Xie, Xiaoxi Ouyang, Lanjuan Li
Cell Prolif. 2020 Sep 19 .
影响因子: 5.753
- YY1-modulated Long Non-coding RNA SNHG12 Predicts and Promotes Gastric Cancer Metastasis via Activating miR-218-5p/YWHAZ-dependent βcatenin: A Bed to Bench Approach
Tian Qi Zhang, Qingqiang Dai, Maneesh Kumarsing Beeharry, Zhenqiang Wang, Liping Su, Chen Li
Research Suare. 2020 Aug 24 .
- SNW1 interacts with IKKγ to positively regulate antiviral innate immune responses against influenza A virus infection
Qiao Zhang, Taizhen Liang, Shuyin Gu, Yilu Ye, Shuwen Liu
Microbes and Infection. 2020 Aug 14 .
影响因子: 2.373
- 非酒精性脂肪性肝炎中Fgl2分子介导的肝脏巨噬细胞活化在肝脂代谢紊乱中的作用和机制研究
胡军剑
华中科技大学. 2020 Aug 05 .
- Fibrinogen-like protein 2 aggravates nonalcoholic steatohepatitis via interaction with TLR4, eliciting inflammation in macrophages and inducing hepatic lipid metabolism disorder
Junjian Hu,Hongwu Wang,Xitang Li,Yonggang Liu,Yuqiang Mi,Hongyan Kong,Dong Xi,Weiming Yan,Xiaoping Luo,Qin Ning, Xiaojing Wang
Theranostics. 2020 Aug 01 ; 21
影响因子: 8.579
- MicroRNA-146a在阿霉素诱导心肌损伤中的保护作用及机制研究
潘建安
上海交通大学. 2020 Jun 04 .
- DAXX抑制胃癌的干细胞特性及上皮-间充质转化的机制研究
伍超凡
苏州大学. 2020 Jun 01 .
- AZIN-1小分子抑制剂抗非小细胞肺癌A549活性的研究
王顺超
三峡大学. 2020 May 01 .
- CNPase在后发性白内障上皮-间质转化中的作用和机制研究
李玥
天津医科大学. 2020 May 01 .
- EGLN1通过促进p53泛素化参与鼻咽癌细胞的生物学行为及放射敏感性的调节
孙璐
华中科技大学. 2020 May 01 .
- PP4R1 interacts with HMGA2 to promote non-small-cell lung cancer migration and metastasis via activating MAPK/ERK-induced epithelial-mesenchymal transition
Bin Wang, Lin‐Yue Pan, Ning Kang, Xiao‐Yong Shen
Mol Carcinog. 2020 Feb 19 ; 5
影响因子: 3.411
- Berberine increases glucose uptake and intracellular ROS levels by promoting Sirtuin 3 ubiquitination
Wei Li, Dan Li, Hongying Kuang, Xiaoling Feng, Wenxia Ai, Ying Wang, Simao Shi, Jing Chen, Ruifeng Fan
BIOMED PHARMACOTHER. 2020 Jan 01 .
影响因子: 3.743
- Red blood cell–derived nanoerythrosome for antigen delivery with enhanced cancer immunotherapy
XIAO HAN,SHUFANG SHEN,QIN FAN,GUOJUN CHEN,EDIKAN ARCHIBONG,GIANPIETRO DOTTI,ZHUANG LIU,ZHEN GU, CHAO WANG
science advances. 2019 Aug 23 .
影响因子: 14.136
- 促红细胞生成素改善肝脏脂肪变性及抑制内质网应激的机制研究
洪汀
南京大学. 2019 May 20 .
- DUSP8对MSI-H型和MSS型人结直肠癌细胞生长和凋亡的影响及机制研究
丁涛
遵义医科大学. 2019 May 01 .
- MMP9通过结合IFNAR1抑制IFN/JAK/STAT通路促进EV71复制
蒋曦
北京协和医学院. 2019 May 01 .
- Tomatidine通过调控破骨细胞分化减少雌激素缺乏导致的骨量丢失的实验研究
胡斌
浙江大学. 2019 May 01 ; 3
- 全基因组组蛋白H3K27乙酰化谱改变在慢性小鼠肠炎发病机制中的作用研究
陈梦
武汉大学. 2019 Apr 01 .
- 胰岛再生源蛋白RegⅢγ对大鼠肝细胞BRL-3A生长的作用及机制研究
赵聪聪
河南师范大学. 2018 May 01 ; 1